Como a Internet das Coisas pode aprimorar o serviço de saúde?
Essa notícia foi publicada no portal Jota.info e está disponível em: https://www.jota.info/opiniao-e-analise/artigos/internet-das-coisas-saude-12062018
Os desafios regulatórios na implementação da Internet das Coisas na área da saúde
Pixabay
Em mais um artigo da série sobre o direito e a Internet das Coisas (“Internet of Things” ou “IoT”), em parceria com o JOTA, discutiremos as contribuições de IoT na área de saúde, compreendendo as complexidades dessa intersecção sob duas perspectivas principais: (i) o panorama geral do sistema de saúde e possíveis contribuições de IoT; (ii) algumas barreiras e desafios regulatórios para o desenvolvimento de IoT nesse setor.
Panorama geral
Inicialmente, importante explicar que, de forma geral, Internet das Coisas tem por finalidade habilitar serviços avançados por meio da interconexão entre coisas (físicas e virtuais), com base nas tecnologias de informação e comunicação (TIC). Assim, a utilização dessa tecnologia pode contribuir para o avanço de diversos setores da economia e garantir maior acesso e eficiência na prestação de serviços públicos à população.
Nesse contexto, o Ministério de Ciência, Tecnologia, Inovações e Comunicações (“MCTIC”) e o Banco Nacional de Desenvolvimento Econômico e Social (“BNDES”) firmaram um Acordo de Cooperação em dezembro de 2016 e juntos coordenaram o estudo “Internet das Coisas: um plano de ação para o Brasil” realizado pelo consórcio McKinsey / CPqD / Pereira Neto Macedo Advogados, no qual foi priorizada a análise de setores considerados estratégicos para o desenvolvimento de IoT no país.
Um dos setores priorizados, foi o da saúde, o qual, segundo a pesquisa Visão Brasil 2030 é considerado por 75% dos brasileiros como o setor que deve ser considerado prioritário, e cuja qualidade é ruim ou péssima para 44% da população. Esses dados evidenciam, portanto, um descompasso na percepção da população entre aquilo que necessita e o que efetivamente recebe no setor de saúde.
A aplicação de IoT no ambiente de saúde pode contribuir tanto para a melhoria da qualidade de vida das pessoas como para o aumento da eficiência das unidades de saúde. Contribui para enfrentar, assim, o desafio relacionado ao aumento dos gastos com saúde, cuja tendência de aumento nos próximos anos, principalmente em razão do envelhecimento da população e da consequente diminuição das pessoas economicamente ativas.
Assim, no referido estudo foram definidas as seguintes aspirações para o desenvolvimento de IoT no ambiente da saúde: (i) ampliação do acesso à saúde de qualidade no Brasil por meio da criação de uma visão integrada dos pacientes, (ii) descentralização da atenção à saúde, e (iii) melhoria de eficiência das unidades de saúde.
O estudo evidenciou também que existem diversas barreiras para o desenvolvimento e adoção de IoT em saúde no Brasil, como questões regulatórias, o desafio da privacidade dos dados clínicos dos pacientes, conectividade em áreas remotas, disponibilidade de recursos para avaliação de custo-efetividade das tecnologias, entre outros.
Contribuições da IoT
Diante disso, pergunta-se como a Internet das Coisas pode ajudar a aprimorar o serviço de saúde no Brasil? As soluções de IoT podem, exatamente, contribuir para a superação dos desafios na área da saúde a um menor custo, com significativo incremento de eficiência. Apenas no Brasil, a estimativa trazida no referido relatório é que o desenvolvimento de IoT produza um ganho econômico de US$ 5 a US$ 39 bilhões.
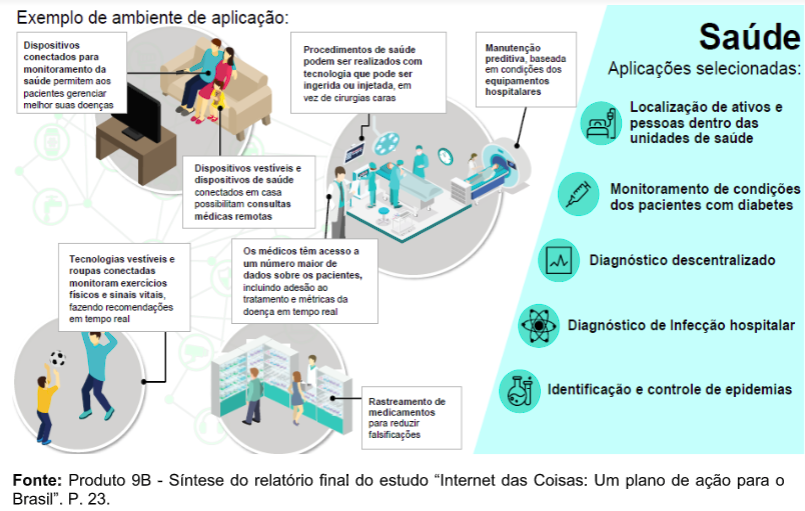
Analisando os principais desafios na área, o estudo identificou que IoT pode ter maior impacto sobre quatro deles: (i) tratamento de doenças crônicas; (ii) tratamento de doenças infectocontagiosas; (iii) promoção e prevenção da saúde; e (iv) melhoria na eficiência de gestão.
Assim, tendo em vista o impacto para a área da saúde, o estudo selecionou cinco aplicações de IoT – as quais não são excludentes em relação a outras milhares de aplicações possíveis: (i) monitoramento remoto das condições dos pacientes com diabetes; (ii) localização de ativos nas unidades de saúde (RTLS – Real-Time Location Systems); (iii) apoio ao diagnóstico de sepse; (iv) diagnóstico descentralizado; e (v) identificação e controle de epidemias. [1]
Importante ressaltar que atualmente já existem experiências de aplicações de IoT no Brasil na forma de pilotos, desenvolvidas pelo Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (USP), pelo Hospital Israelita Albert Einstein e Hospital 9 de Julho, bem como por startups no Sul e no Sudeste do país. Algumas delas são voltadas ao cadastro automático de informações, ao transporte em cadeiras de rodas e macas e à prevenção do risco de queda de pacientes.
Mas qual o caminho a seguir para a implementação dessas aplicações? Existem barreiras a serem supridas?
De acordo com o quadro abaixo, desenvolvido no âmbito do referido estudo, existem barreiras relacionadas a deficiências de (i) capital humano, (ii) inovação e inserção internacional; (iii) barreiras regulatórias e de segurança e privacidade; e (iv) infraestrutura de conectividade e interoperabilidade.

Nesse artigo, abordaremos as barreiras e desafios regulatórios. Na sequência de artigos dessa série, abordaremos especificamente a garantia da privacidade e proteção de dados na área da saúde.
Aspectos e desafios regulatórios
A partir do mapeamento das normas que impactam o setor, de entrevistas com técnicos da ANVISA, e de contribuições de representantes do setor que participaram dos workshops conduzidos pelo BNDES e pelo MCTIC, foram identificados alguns dos principais aspectos regulatórios que impactam o desenvolvimento de IoT no ambiente da saúde.
O primeiro deles refere-se à necessidade de submissão dos produtos de interesse à saúde, à vigilância sanitária, por meio do registro ou cadastro dos mesmos. De acordo com o art. 8º da Lei nº 9.782/99 incumbe à ANVISA regulamentar, controlar e fiscalizar os produtos e serviços que envolvam risco à saúde pública, devendo ser submetidos ao seu controle: (i) medicamentos de uso humano, suas substâncias ativas e demais insumos, processos e tecnologias; (ii) conjuntos, reagentes e insumos destinados a diagnóstico; (iii) equipamentos e materiais médico-hospitalares, odontológicos e hemoterápicos e de diagnóstico laboratorial e por imagem; (vi) radioisótopos para uso diagnóstico in vivo e radiofármacos e produtos radioativos utilizados em diagnóstico e terapia; e (vii) quaisquer produtos que envolvam a possibilidade de risco à saúde, obtidos por engenharia genética, por outro procedimento ou ainda submetidos a fontes de radiação.
Os serviços para a saúde, por sua vez, são definidos no parágrafo seguinte do dispositivo acima citado como aqueles voltados para a atenção ambulatorial, seja de rotina ou de emergência, os realizados em regime de internação, os serviços de apoio diagnóstico e terapêutico, bem como aqueles que impliquem a incorporação de novas tecnologias. Tendo em vista que a tecnologia IoT é desenvolvida por meio de dispositivos, por mais que eles possam ter impacto sobre os serviços de saúde, não haverá incidência das regras que regulamentam os serviços de saúde sobre IoT.
A Resolução da Diretoria Colegiada nº 185 de 2001 (“RDC 185/2001”) deu um passo além e definiu os produtos médicos como aqueles destinados à prevenção, diagnóstico, tratamento, reabilitação ou anticoncepção, sem uso de meio farmacológico, imunológico ou metabólico para realizar sua principal função. Em síntese, produtos com finalidade terapêutica ou diagnóstica.
Tal definição, ainda ampla, tem potencial de gerar insegurança quanto ao enquadramento regulatório do produto que envolva alguma solução tecnológica, como já ocorreu no caso do enquadramento do software para a saúde, cujo procedimento pode ser utilizado como parâmetro para aplicações de IoT.
Diante das dúvidas acerca do enquadramento de software, a ANVISA emitiu a Nota Técnica n° 04/2012/GQUIP/GGTPS/ANVISA com orientações sobre a forma de enquadramento desse produto, dividindo-os em três categorias.
A primeira delas é o software produto para a saúde, produto independente, que não precisa de um hardware para funcionar. Sendo produto para a saúde, é necessário que seja registrado ou cadastrado perante a ANVISA. Como exemplos têm-se os softwares para posicionamentos cirúrgicos e diagnóstico de uma doença, como o Software Match It! DNA e o Sistema de Captura de Imagens e Gestão de Laudos ZSCAN.
A segunda delas é o software parte (ou acessório) de um produto para a saúde, que não pode funcionar sozinho e precisa de um hardware. Em regra, por integrar outro produto, esse modelo precisa ser registrado ou cadastrado em conjunto com o hardware de que depende. Os exemplos são softwares que, por exemplo, controlam funções de um dispositivo médico ou que transferem informações, como o Picture Archiving and Communication System (PACS).
Por fim, a terceira é relativa ao software não produto para a saúde, que não possui finalidade terapêutica ou diagnóstica e, consequentemente, não necessita de registro nem de cadastro perante a ANVISA. Os exemplos desse tipo de software são os aplicativos voltados para a prática esportiva e para o lazer, como o Apple Watch e o Fit Bit.
Após a compreensão de que os equipamentos que envolverem tecnologia IoT devem ou não ser submetidos à vigilância sanitária, o estudo também mapeou o processo de registro e cadastro desses produtos constatando que ele apresenta diversas etapas e esbarra em novas dificuldades de enquadramento dos produtos.
De maneira resumida, o procedimento para registro é disciplinado pela RDC 185/01 e deverá ser concedido em 90 dias (cf. § 1º do art. 7º do Decreto nº 8.077/2013). Já o procedimento para cadastro é mais simples e encontra-se regulamentado pela Resolução da Diretoria Colegiada nº 40 de 2015 (“RDC 40/2015”). Na imagem abaixo, é possível visualizar o fluxograma com todo o procedimento para solicitação de Registro ou Cadastro perante a ANVISA.
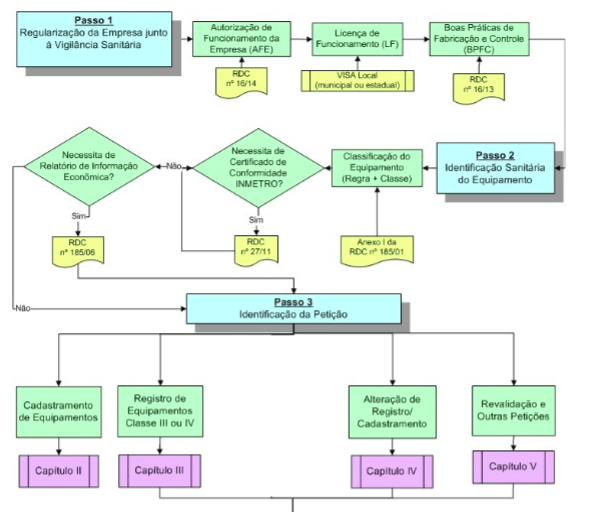
Do fluxograma acima verifica-se que existem diversos passos prévios à obtenção do registro ou cadastro de produto de interesse à saúde, como a necessidade de regularização da empresa junto à vigilância sanitária, por meio da obtenção (i) da Autorização de Funcionamento da Empresa (“AFE”), (ii) da Licença de Funcionamento Local (“LF”); (iii) do Certificado de Boas Práticas de Fabricação e Controle (“CBPF”), cuja descrição detalhada pode ser encontrada no “Manual para regularização de equipamentos médicos na ANVISA” ou no Produto 8 – Relatório do Plano de Ação – Capítulo Regulatório.
Além disso, é necessária a identificação sanitária do equipamento, a partir da avaliação do enquadramento do produto nas classes de risco de I a IV. Em seguida, o produto deve ser enquadrado por regras, as quais obedecem à indicação e finalidade de uso do equipamento. São as seguintes: (i) produtos não invasivos – regras 1 a 4; (ii) produtos invasivos – regras 5 a 8; (iii) produtos ativos – regras 9 a 12; e (iv) regras especiais – regras 13 a 18 (cf. Anexo II do Regulamento Técnico aprovado pela RDC 185/01).
Da leitura da Resolução da ANVISA observa-se que existem diversas regras, que por vezes podem apresentar critérios complexos de classificação, o que poderá representar dificuldade para enquadramento dos produtos por parte dos agentes e consequente acréscimo de tempo ao processo.
Por fim, importante ressaltar que, além das normas da ANVISA, o referido estudo também analisou as normas dos Conselhos de Medicina, constatando que atualmente as normas desses conselhos não parecem impactar IoT. Contudo, é possível que o avanço dessa tecnologia resulte em inovações que demandem a atualização dessas normas. Neste ponto, vale ressaltar a importância de que essas normas harmonizem adequadamente a proteção à saúde e os interesses médicos, estimulando os avanços tecnológicos.
Desafios para o regulador
Finalmente, chegando ao último ponto deste artigo, cuidamos dos desafios para a regulação adequada para as aplicações na área de saúde, pensando na dinamicidade do desenvolvimento tecnológico e nos riscos trazidos por ele. Nesse sentido, identificam-se como desafios (i) a necessidade de atualização da regulação setorial e (ii) a proteção à privacidade e segurança de dados pessoais.
Em relação ao primeiro ponto, é necessário que a regulação seja capaz de acompanhar os avanços tecnológicos na área de saúde. A definição de produtos para a saúde adotada pela ANVISA pode gerar dúvidas quanto ao enquadramento de aplicações de IoT inovadoras e aos riscos que apresentam. Exemplo desse desafio refere-se ao enquadramento dos produtos combinados (drug-device combination products), que são produtos terapêuticos e diagnósticos que combinam remédio com dispositivos.
Tendo em vista que a definição de produto para a saúde presente na RDC 185/2001 excluiu dessa classificação os produtos que utilizem meio farmacológico, surge a dúvida acerca de qual seria o enquadramento sanitário desse tipo de produto, bem como sobre como a Agência regulamentará outros produtos complexos que venham a surgir a partir do avanço tecnológico.
Além da necessidade de constante atualização das normas que regulam um setor em constante desenvolvimento, outro desafio que se coloca é a dificuldade de a regulação setorial conseguir traduzir ou endereçar os riscos à saúde pública relacionados aos softwares enquanto dispositivos médicos, ou à soluções de IoT especificamente. Soma-se a esse desafio a necessidade de garantir o apropriado equilíbrio entre proteção ao paciente/consumidor e promoção da saúde pública por meio do incentivo à inovação.
Por isso, o International Medical Device Regulators Forum (“IMDRF”), fórum internacional de reguladores de diversos países, está regularmente atualizando as normas que dispõem sobre software como dispositivo médico, de forma a garantir convergência regulatória entre os órgãos reguladores dos diversos países que o compõem.
Vale mencionar também que a regularização de softwares como dispositivos médicos está na agenda regulatória da ANVISA para o ciclo quadrienal de 2017 a 2020, embora ainda não haja processo regulatório aberto para tratar do tema.
Em relação ao segundo ponto, assim como outras aplicações de IoT, aquelas voltadas para a saúde podem envolver a coleta de dados pessoais. Neste ponto, existem duas preocupações principais: uma diz respeito à privacidade e à proteção desses dados, geralmente considerados sensíveis; e a outra é relativa ao acesso a esses dados para fins de formulação de políticas públicas e de desenvolvimento do setor.
Em outro artigo dessa série sobre IoT, traçamos um panorama acerca dos riscos à privacidade decorrentes da baixa segurança dos dispositivos de IoT e apontamos a necessidade de construção de um ambiente de confiança e de um ambiente institucional adequado para a segurança da informação.
A ausência de uma lei geral de proteção de dados impacta IoT, especialmente na área da saúde, onde os dados coletados são considerados sensíveis para o indivíduo. Considerando que o tema da proteção de dados é crítico para o desenvolvimento de IoT e o setor de saúde apresenta particularidades, esse assunto será tratado especificamente em um próximo artigo da série a partir das perspectivas de coleta, processamento, armazenamento, compartilhamento e acesso aos dados pessoais na área da saúde.
Conclusão
A Internet das Coisas tem grande potencial para contribuir com um sistema de saúde mais acessível e eficiente, auxiliando na melhoria desses serviços à população. A regulação, por sua vez, deve ser capaz de acompanhar as peculiaridades das inovações no setor, de forma a incentivar o seu desenvolvimento.
Mateus Piva Adami – professor do programa de pós-graduação lato sensu da FGV Direito SP (GVlaw). Sócio de Pereira Neto, Macedo Advogados
Daniel Douek – mestre em Direito da Concorrência pela King’s College London. Sócio de Pereira Neto, Macedo Advogados.
Manuel Oliveira Camargo – graduada em Direito pela Universidade de São Paulo. Advogada de Pereira Neto, Macedo Advogados.
Os artigos publicados pelo JOTA não refletem necessariamente a opinião do site. Os textos buscam estimular o debate sobre temas importantes para o País, sempre prestigiando a pluralidade de ideias.